Herzkammern im Reagenzglas: Mit Kardioiden die Herzentwicklung verstehen
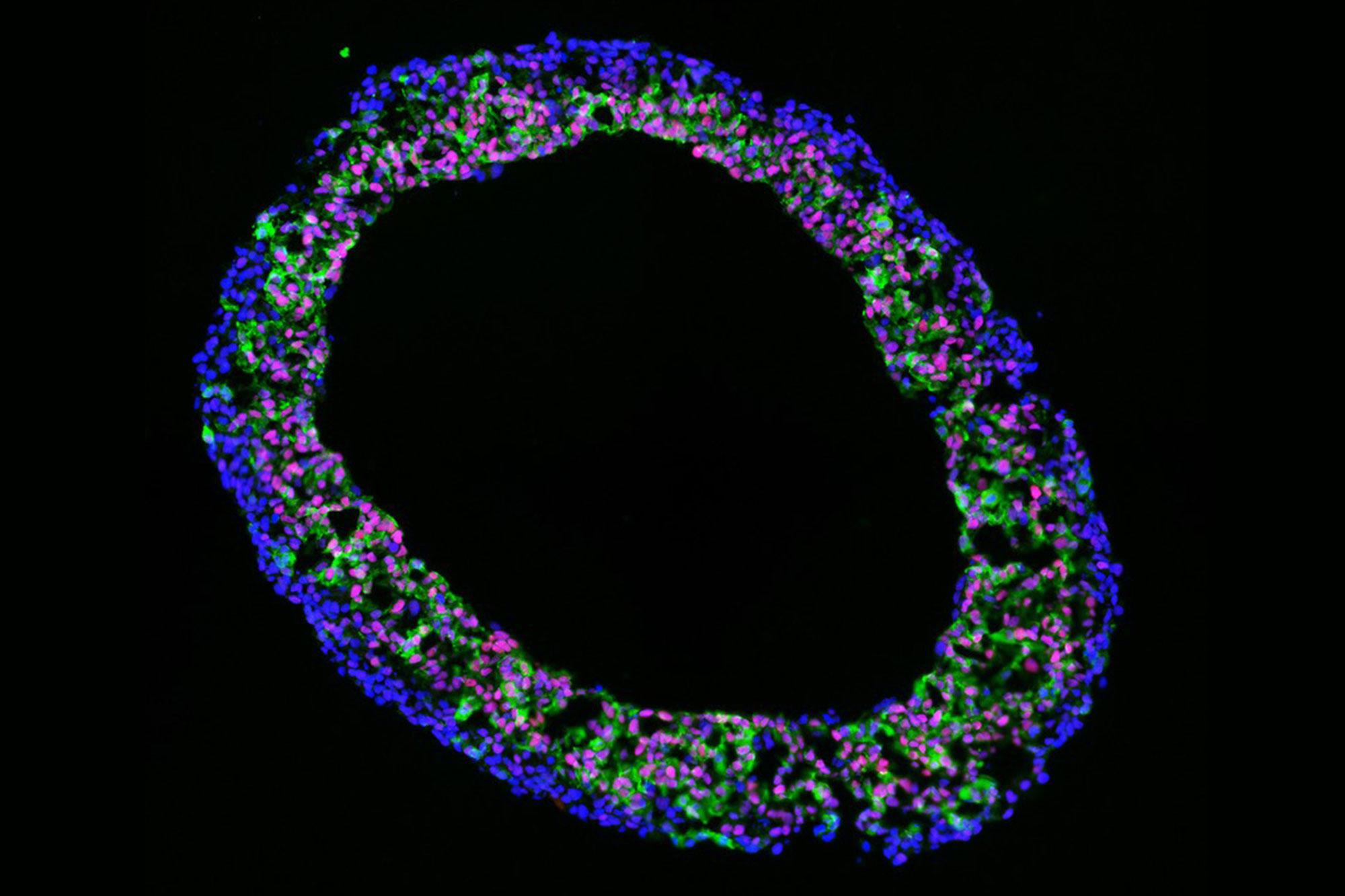
„Herzkammer-Organoide“ aus induziert pluripotenten Stammzellen ermöglichen neue Einblicke in die menschliche Herzentwicklung im Reagenzglas und bieten eine Alternative zur bisherigen Forschung an Mäusen.
Jährlich werden in der Schweiz rund 600 bis 800 Kinder mit angeborenen Herzfehlern geboren. Um die Entstehung solcher Erkrankungen besser verstehen zu können und neue Diagnosen und Therapien zu entwickeln, arbeitet ein Forschungsteam der Universität Bern unter der Leitung von Prof. Marco Osterwalder an innovativen Modellen: Aus menschlichen induziert pluripotenten Stammzellen entwickeln sie „Herz-Organoide“ – kleine, pulsierende Herzkammern im Labor. Diese künstlichen "Kardioide" ermöglichen einen Einblick in die menschliche Herzentwicklung im Reagenzglas und bieten eine tierversuchsarme Alternative zur bisherigen Forschung an Mäusen.
Was sind aus Ihrer Sicht die wichtigsten Ergebnisse und Erkenntnisse ihres NFP 79-Forschungsprojektes?
Basierend auf einem Modell, das ursprünglich von unserem Projektpartner Sasha Mendjan in Wien entwickelt wurde haben wir erfolgreich Kardioide in Bern etabliert. Kardioide werden aus Kulturen von induziert pluripotenten Stammzellen gebildet und entwickeln sich zu kugelförmigen Strukturen, die bis zu 2 Millimeter Durchmesser haben können. Genetisch und funktionell zeigen Kardioide viele Gemeinsamkeiten mit embryonalen Herzkammern, z.B. können wir rhythmische Kontraktionen beobachten. Wir verwenden das Modell, um besser zu verstehen, wie Herz-Gene funktionieren und durch Gen-Schalter, sogenannte Enhancer, reguliert werden. Damit können wir die Mechanismen untersuchen, die möglicherweise für angeborene Herzfehler verantwortlich sind. Also die Frage: Welche Gene und Abschnitte unseres Genoms sind entscheidend, wenn Herzfehler entstehen?
Ein zentrales Ergebnis ist, dass viele der Gene und auch spezifische Enhancer, die im in vivo Maus-Herz aktiv sind, auch im Kardioid aktiv sind, was die Relevanz und Übertragbarkeit des Modells für die Genregulation unterstreicht. Das Modell ermöglicht es, genetische Manipulationen vereinfacht und ohne Tiermodell vorzunehmen und so den Effekt von Mutationen auf die Herzentwicklung im Labor zu simulieren. Dies liefert wichtige Einblicke für zukünftige Studien, speiziell auch im Vergleich mit dem Mausmodell. Derzeit laufen mehrere Projekte dazu. Ein zusätzlicher Schwerpunkt liegt auf der Charakterisierung der Funktion von Herz-Genen und deren Steuerung durch Enhancer im Organoid-System.
Wie sehen die nächsten Schritte im Projekt aus? Wird die entwickelte Methode bereits in der Praxis angewendet oder sind zuerst weitere Entwicklungen notwendig?
Das Modell wird bereits für einzelne Anwendungen genutzt, etwa um genetische und epigenetische Daten zu testen. Parallel dazu arbeitet eine Partnergruppe in Wien mit grossen Datensätzen und maschinellem Lernen, um bessere Vorhersagen für die Herzentwicklung zu machen. Diese Vorhersagen können dann in Herz-Organoiden überprüft werden.
Das bestehende Modell wurde bereits mit Maus-Daten angereichert. Dies ist dann die Grundlage für eine kommende Publikation und für die Entwicklung einer „Karte“ der Steuerung der Herzentwicklung zur Übertragung auf den Menschen. International werden zunehmend Datenquellen verfügbar, darunter auch Informationen von menschlichen embryonalen Herzen, die in Zukunft zur Verbesserung der Vorhersagen genutzt werden können.
Welche Vorteile ergeben sich durch das Modell für die Patientenversorgung?
Diese neue Methode hat grosses Potenzial für die Diagnostik und Behandlung von Herzkrankheiten bei Patienten: Mittels genetischer Diagnosen kann man heute bei Patienten mit einem erhöhten Risiko für einen Herzfehler Mutationen erkennen – oft weiss man allerdings nicht, welche davon tatsächlich problematisch sind. Hier kommt unser Modell ins Spiel: Aus Hautzellen des Patienten könnten zunächst Körperzellen erzeugt werden, aus denen dann Herz-Organoide gezüchtet werden. Diese Kardioide tragen die genetischen Mutationen des Patienten oder auch gezielt eingefügte Gen-Mutationen. So würde sich direkt im Labor beobachten lassen, welchen Einfluss bestimmte Mutationen auf die Aktivität von Genen oder deren Schaltern haben, und wie diese Herzmuskelzellen den Herzrhythmus, beinträchtigen. Das Modell wird damit eine bessere Einschätzung erlauben, ob eine genetische Mutation die Ursache einer Herzerkrankung ist, und es kann auch genutzt werden, um mögliche Therapien zu entwickeln.
Arbeiten Sie in diesem Projekt auch mit anderen Forschungsgruppen zusammen?
Ja, die Zusammenarbeit mit anderen Laboren ist ein zentraler und bereits sehr gut entwickelter Bestandteil unseres Projekts. Hier an der Universität Bern und speziell innerhalb unseres Cardiovascular Research Cluster profitieren wir von einer grossen und gut vernetzten Community mit spezialisierten Labors auf dem Gebiet der kardiovaskulären Forschung. Aktuell bestehen bereits starke lokale Kooperationen, beispielsweise mit der Gruppe von Prof. Katja Odening, welche Ursache und Therapien von Arrhythmien erforscht, mit dem Team um Prof. Nadia Mercader, einer renommierten Expertin für Herzregeneration, und mit der Gruppe von Prof. Camilla Schinner, die sich auf arrhythmogene Kardiomyopathien spezialisiert hat. So wird die Methode aktiv in mehreren führenden Forschungsgruppen auf dem Gebiet der kardiovaskulären Forschung angewandt und weiterentwickelt. Hierbei haben unsere Kardioide auch zentral zum Erfolg des Lighthouse Projekts am Bern Center for Precision Medicine beigetragen.
Welche Hürden müssen bewältigt werden, bevor die Methode breiter implementiert werden kann?
Grundsätzlich ist die Methode gut erlernbar, wenn das nötige Know-how und die Infrastruktur vorhanden sind. Eine wesentliche Herausforderung ist jedoch die Finanzierung, da diese Forschung ziemlich kostenintensiv ist. Zudem ist man abhängig von der Qualität und Verfügbarkeit des biologischen Ausgangsmaterials. Eine weitere Herausforderung ist die natürliche Variabilität dieser Modelle im Vergleich zu in vivo-Systemen, die allerdings auch als Chance gesehen werden kann, da sie biologische Diversität besser abbildet.
Welche sind die wichtigsten Stakeholder im Projekt?
Wichtige Stakeholder sind vor allem im Forschungssektor angesiedelt. In Bern gibt es ein Netzwerk mit zahlreichen Forschungsgruppen, das sich kardiovaskulären Themen widmet. Darüber hinaus bestehen enge Kontakte zur Klinik, wo unter anderem Co-Applikant Christian Zuppinger lange tätig war, sowie Verbindungen zur Pharmaindustrie und Medizintechnik, die das Projekt unterstützend begleiten.
Sie setzen im Projekt Künstliche Intelligenz ein. Wie unterstützt diese Technologie Ihre Forschung?
Im Projekt wird Künstliche Intelligenz vor allem für die Vorhersage von Gen-Regionen eingesetzt. Eine Partnergruppe aus Wien nutzt Machine Learning, um aus grossen Datenmengen präzise Prognosen zu erstellen, welche Gene funktional relevant sind, ohne dass dafür aufwändige Experimente nötig sind.
Das Ziel ist, mit Hilfe dieser KI-basierten Vorhersagen den Einsatz von Tierversuchen deutlich zu reduzieren, indem experimentelle Modelle gezielter und effizienter eingesetzt werden. Das Gebiet entwickelt sich sehr schnell und bietet grosses Potenzial, die Forschung und Krankheitsmodelle weiter zu verbessern.
Auch die von uns generierten Ausgabedaten fliessen in die KI-Analysen ein, wodurch ein wertvoller Kreislauf aus Daten und Vorhersagen entsteht.
