Le cœur en éprouvette : comprendre la cardiogenèse grâce aux organoïdes
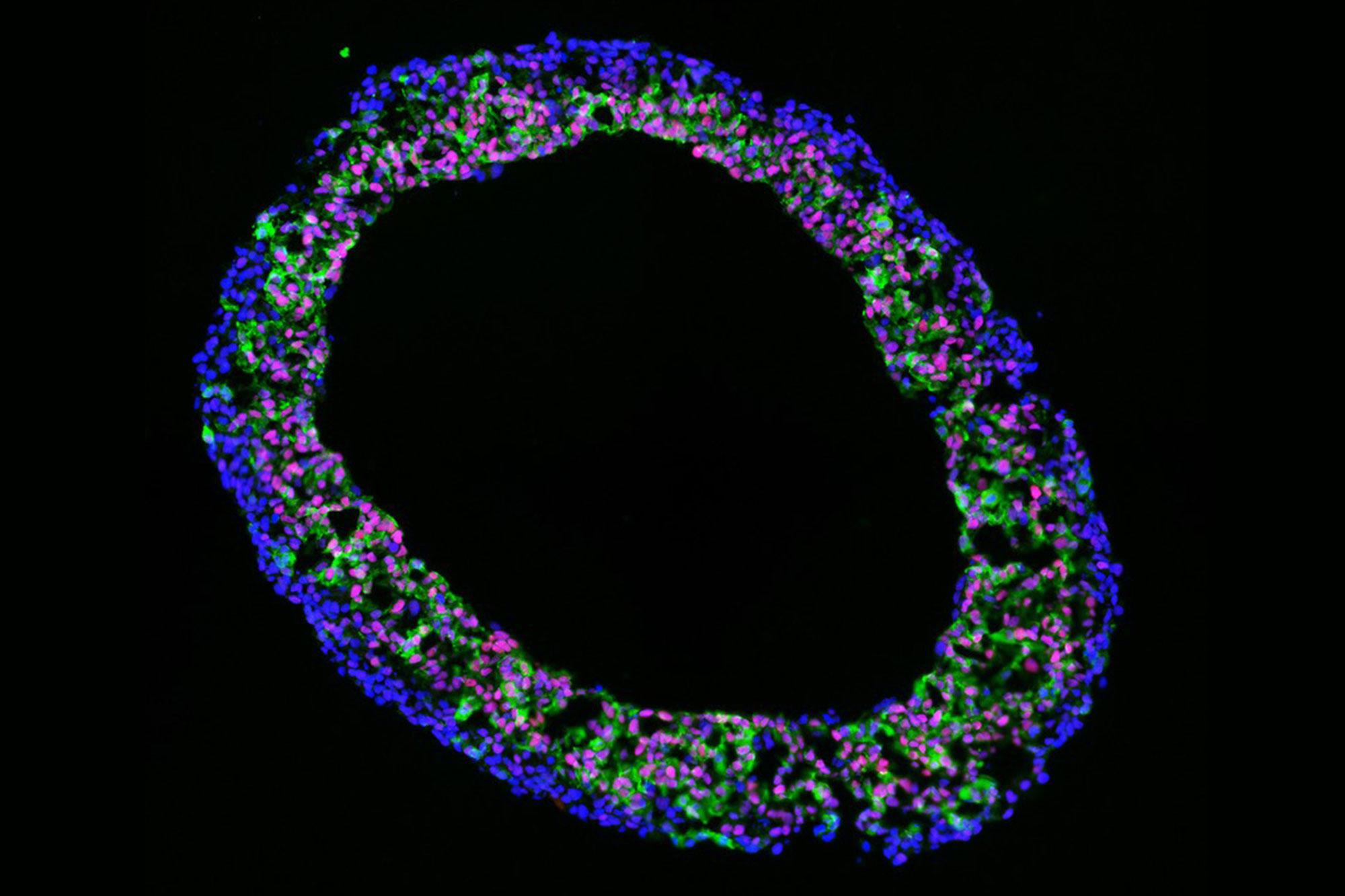
Les « organoïdes ventriculaires » issus de cellules souches pluripotentes induites permettent d’obtenir un nouvel aperçu du développement cardiaque humain et offrent une alternative in vitro à la recherche menée sur les souris.
En Suisse, près de 600 à 800 enfants par an naissent avec une malformation cardiaque congénitale. Afin de mieux comprendre la genèse de ces pathologies et de pouvoir développer de nouvelles méthodes diagnostiques et thérapies, une équipe de recherche de l’Université de Berne placée sous la direction du Prof. Marco Osterwalder travaille à développer des modèles cellulaires innovants. A partir de cellules souches pluripotentes induites ou « iPSCs », les chercheuses et chercheurs élaborent en laboratoire des « organoïdes cardiaques » : de petites cavités pulsantes qui forment des chambres similaires à celles d’un cœur. Ces « cardioïdes » permettent d’obtenir un nouvel aperçu du développement cardiaque humain et offrent une alternative in vitro aux expériences qui étaient jusqu’à présent effectuées sur des souris.
Quels sont selon vous les principaux résultats et conclusions du projet de recherche que vous avez mené dans le cadre du PNR 79 ?
A partir d’un modèle qui avait initialement été développé par notre partenaire de projet Sasha Mendjan à Vienne, nous avons réussi à élaborer des cardioïdes à Berne. Ces organoïdes cardiaques sont formés à partir de cultures de cellules souches pluripotentes induites et forment des structures sphériques pouvant atteindre jusqu’à 2 millimètres de diamètre. Ils présentent de nombreuses similitudes avec les ventricules embryonnaires d’un point de vue génétique comme fonctionnel, et on peut par exemple observer des contractions rythmiques. Ce modèle nous permet de mieux comprendre comment les gènes cardiaques fonctionnent. Et comment ils sont régulés par des commutateurs génétiques appelés enhancers. Nous pouvons ainsi étudier les mécanismes susceptibles d’être à l’origine de malformations cardiaques congénitales. En d’autres termes, nous travaillons à déterminer quels sont les gènes et les séquences de notre génome qui jouent un rôle décisif dans l’apparition de ces pathologies.
Une de nos plus importantes observations est qu’un grand nombre des gènes et enhancers spécifiques qui sont actifs in vivo dans le cœur des souris sont également actifs dans les cardioïdes – ce qui confirme la pertinence et la transférabilité de ce modèle pour l’étude de la régulation des gènes. En permettant de stimuler en laboratoire l’effet qu’exercent différentes mutations sur le développement cardiaque, il simplifie les manipulations génétiques et rend aussi inutile l’expérimentation sur les animaux. Cette avancée ouvre des pistes importantes pour de futures études, notamment par rapport au modèle de souris, et plusieurs projets sont en cours sur le sujet. Un autre des points forts du système organoïde est qu’il offre la possibilité de caractériser la fonction des gènes cardiaques et d’identifier les enhancers qui les contrôlent.
Quelles sont les prochaines étapes que vous envisagez ? La méthode développée trouve-t-elle déjà une application pratique, ou d’autres développements doivent-ils d’abord intervenir ?
Le modèle est d’ores et déjà utilisé à certaines fins, par exemple pour tester des données génétiques et épigénétiques. A Vienne, un groupe partenaire recourt parallèlement à l’apprentissage automatique pour exploiter de grands ensembles de données et établir des pronostics plus précis sur le développement cardiaque, pronostics que le cardioïde pourra ensuite permettre de vérifier.
Le modèle existant a déjà été enrichi avec des données issues de la souris. Ces travaux serviront de base à une prochaine publication et à l’élaboration d’une « carte » du contrôle du développement cardiaque en vue de sa transposition à l’être humain. De plus en plus de sources de données sont également disponibles au plan international, y compris des informations relatives à des cœurs embryonnaires humains, lesquelles pourront à l’avenir aussi être utilisées pour améliorer ces pronostics.
Quels avantages ce modèle présente-t-il pour le traitement des patient·es ?
Cette nouvelle méthode recèle un grand potentiel pour le diagnostic et le traitement des maladies cardiaques : si les tests génétiques permettent aujourd’hui de détecter les mutations présentant un risque accru de malformations cardiaques, ils ne permettent généralement pas de déterminer celles qui risquent de se révéler réellement problématiques. C’est là qu’intervient notre modèle : il suffit de prélever quelques cellules cutanées pour pouvoir produire des cellules du corps entier et cultiver ensuite des cardioïdes à partir de celles-ci. Ces cardioïdes porteraient les mutations génétiques des patient·es, ou des mutations génétiques insérées de manière ciblée. Il serait ainsi possible d’observer directement en laboratoire l’influence que certaines mutations exercent sur l’activité de gènes ou de leurs commutateurs, et la manière dont elles affectent le muscle et le rythme cardiaque. Notre modèle permettra ainsi de mieux évaluer si une pathologie cardiaque est d’origine génétique et pourra également être utilisé pour développer d’éventuelles thérapies.
Travaillez-vous à ce projet avec d’autres groupes de recherche ?
Oui, la collaboration d’autres laboratoires constitue une composante essentielle de notre projet et que nous avons déjà fort bien développée. Ici, à l’Université de Berne, et plus particulièrement au sein de notre Cardiovascular Research Cluster, nous bénéficions d’une importante communauté interconnectée qui dispose de laboratoires spécialisés dans le domaine de la recherche cardiovasculaire. Nous avons aussi établi de solides coopérations à l’échelle locale, par exemple avec l’équipe de la Prof. Katja Odening qui étudie les causes et les traitements de l’arythmie cardiaque, celle de la Prof. Nadia Mercader, une experte renommée de la régénération cardiaque, et celle de la Prof. Camilla Schinner qui s’est spécialisée dans les cardiopathies arhythmogènes. Cette méthode est de fait activement utilisée et continue d’être développée, par plusieurs groupes qui se situent à la pointe de la recherche cardiovasculaire. Nos cardioïdes ont parallèlement joué un rôle essentiel dans le succès du projet Lighthouse mené au Bern Center for Precision Medicine.
Quels obstacles restent-ils à surmonter avant que la méthode soit déployée à plus large échelle ?
Si le savoir-faire et l’infrastructure nécessaires sont disponibles, la méthode est en principe facile à acquérir. Le principal défi concerne le financement, car ces travaux s’avèrent relativement onéreux. De plus, les chercheuses et chercheurs sont tributaires de la qualité et de la disponibilité du matériel biologique. La variabilité naturelle que présentent ces modèles humains par rapport aux modèles animaux étudiés in vivo constitue une autre difficulté, qui peut toutefois aussi être considérée comme une opportunité, car les iPSC humains permettent de mieux représenter la diversité biologique.
Quelles sont les principales parties prenantes ?
La plupart des acteurs impliqués dans le projet appartiennent au secteur de la recherche. A Berne, il existe un réseau constitué de nombreux groupes qui se consacrent à des thèmes cardiovasculaires. Nous entretenons par ailleurs des contacts étroits avec la clinique universitaire où Christian Zuppinger, mon co-réquérant, a entre autres longtemps travaillé ainsi qu’avec des partenaires issus de l’industrie pharmaceutique et de la technique médicale, qui accompagnent le projet.
Vous vous servez de l’intelligence artificielle. Quel est l’apport de cette technologie à votre recherche ?
Dans le projet, l’intelligence artificielle est principalement utilisée pour la prédiction des régions génétiques. Une équipe partenaire de Vienne utilise l’apprentissage automatique pour analyser d’importantes quantités de données afin d’établir des prédictions précises sur les gènes fonctionnellement pertinents, sans qu’il soit nécessaire de réaliser des expériences complexes.
L’objectif est de s’appuyer sur les pronostics basés sur l’IA pour réduire nettement le recours à l’expérimentation animale et d’utiliser les modèles expérimentaux de manière plus ciblée et plus efficace. Ce domaine évolue très rapidement et offre un important potentiel eu égard à l’amélioration de la recherche et à la modélisation des maladies.
Les données que nous générons viennent également alimenter les analyses assistées par IA, si bien qu’il en résulte un cercle vertueux d’outputs et de prévisions qui enrichit nos résultats.
